Tendinopatie: Jak vznikají a jak se léčí
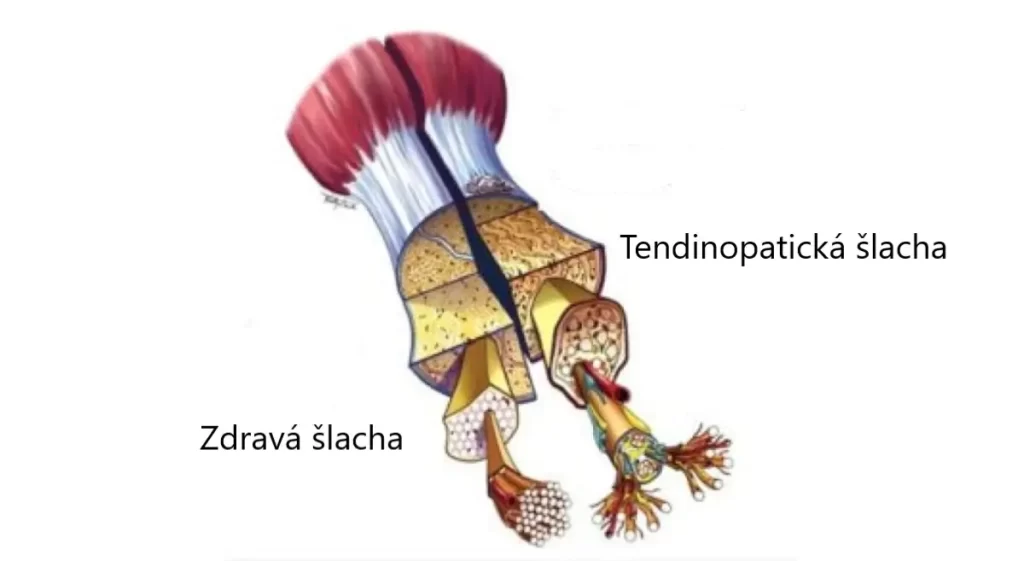
V poslední době je v medicíně a fyzioterapii skloňován výraz tendinopatie, což je označení pro bolest šlachy vzniklé na základě přetěžování šlachy a následné mikrotraumatizaci její struktury. V dřívějších letech byl pro obtíže šlachy využíván spíše pojem tendinitida, tedy zánět šlachy. Nicméně, novodobé studie postupně odkrývají příčinu obtíží a diagnóza zánět šlachy ustupuje do pozadí.
Tendinopatie jsou obecně velice častou příčinou bolesti, neboť vznikají jako důsledek nadměrného přetěžování svalů a jejich šlach ať sportovní nebo pracovní činností. Není tak divu, že se tyto problémy objevují obvykle u sportovců. Mezi šlachy, které mají největší riziko vzniku tendinopatie, patří na dolní končetině Achillova šlacha (především u běžců) nebo patelární šlacha kolene (u volejbalistů, basketbalistů..) známé jako skokanské koleno. Na horní končetině se pak nejčastěji objevuje tendinopatie u šlach extenzorů předloktí, které obvykle nacházíme pod názvem tenisový loket. Dále pak nacházíme bolesti šlachy u svalů rotátorové manžety ramene (především u tenistů, baseballistů..).
Jak vzniká tendinopatie?
Mechanické zatížení šlachy (např. cvičením) vede k anabolickému procesu (tvorbě tkáně) díky umocnění exprese kolagenního genů a zvýšení tvorby kolagenních proteinů. Tento děj vrcholí 24h po cvičení a zůstává zvýšen až po dalších 70-80 hodin. Nicméně, cvičení vede také k degradaci kolagenních proteinů, ačkoli tento katabolický děj vrcholí dříve než anabolický. Výsledkem je tedy katabolismus, tedy čistá ztráta kolagenu okolo 24-36 hodin po tréninku, následovaný čistým přírůstem kolagenu (anabolismus). Tedy určitý čas pro obnovení tkáně mezi koloběhem tréninků je kritický pro to, aby došlo k adaptaci tkáně a vyhnuli se čistě katabolické situaci.
Šlacha je schopna adaptovat se na zátěž díky specifickým vlastnostem anatomických struktur, které jsou buď v nebo okolo šlachy – buňky šlachy tenocyty, extracelulární matrix a nervovým zakončením. Opakovaná zátěž vede k produkci zánětlivých molekul tenocyty mikrotrhlinám kolagenních vláken. Po opakovaném mechanickém zatížení nacházíme ve šlaše zvýšení hladiny zánětlivých mediátorů (prostaglandin E2). Na pozadí tendinopatie byla také pozorována přítomnost zánětu při signifikantní infiltraci makrofágů, žírných buněk, B a T lymfocytů. Tyto nálezy ve změně imunitního systému nám pak mohou napovědět v prvotních fázích probíhající tendinopatie. S určitou pravděpodobností zánětlivé buňky aktivují kaskádu prozánětlivých cytokininů, které nacházíme při tendinopatii.
Buňky šlachy a fibroblasty vystavované opakovanému mechanickému zatížení v kombinaci s prozánětlivými cytokininy a stimulací přetvářejícího růstového faktoru Beta (TGF-beta), se můžou přeměnit na myofibroblasty. Myofibroblasty jsou buňky důležité pro hojení šlachy, stejně tak i adaptaci tkáně. Potom co je hojící proces dokončen a mechanická zátěž uvolní myofibroblasty, buňky podstoupí programovanou buněčnou smrt (apoptózu). Pokud tento mechanismus selže, myofibroblasty budou šířit hyperproliferační proces, fibrózu – jeden z hlavních histologických rysů tendinopatie.
Další faktor, který může vést k hyperproliferaci fibroblastů je hypoxie, která může změnit regulaci matrix metalloproteinázy vedoucí ke změně vlastnosti materiálů šlachy. Hypoxie upreguluje růstový faktor cévního endotelu, který může iniciovat vrůstání drobných cév (neoangiogenze) do šlachy. Neoangiogenze je dnes považována za jeden z možných faktorů vzniku bolesti, jelikož např. skleroterapie vede k uvolnění bolesti u tendinopatie. Cévy samo o sobě nejsou bolestivé, nicméně vrůstání senzorických nervových vláken podél krevních cév může vyvolat bolestivou reakci na mechanickou a chemickou stimulaci. Zdravé nebolestivé šlachy jsou uvnitř (v intrafascikulární matrix) téměř aneuronální. Naopak, chronicky bolestivé šlachy vykazují vrůstání senzorických nervů z okolních struktur, např. z přilehlé membrány (paratenonu), což vede uvolnění nociceptivních látek. Omezením prorůstání drobných nervů pomocí denervace (např. miniinvazivním chirurgickým zákrokem) vede taktéž k úlevě od bolesti.
Zajímavé je, že prorůstání nervů do šlachy může být odpovědi na opakovanou zátěž, ale i reakcí na zranění. Při reparaci šlachy vrůstání senzorických nervů je spojeno se zvýšením nocicepce. Následuje vrůstání autonomních nervů, které je paradoxně spojeno se snížením nocicepce a retrakce nervů. Nicméně, při tendinopatii se vrůstající senzorické nervy nestahují jako při normálním hojení. Takže neuronální dysreagulace během tendinopatie charakterizována odchylkou v “pučení” nový senzorických vláken, může poukazovat na selhávající hojící proces, vedoucí ke zvýšení signalizace bolesti a možných proliferativních změn spojených s tendinopatií.
Kromě přenosu bolesti, periferní nervy reagují na mechanické stimuly a uvolňují některé chemické substance, které se za normální situace podílí na hojení a udržování homeostázy, ale při delším uvolňování způsobují fibrózu. Tendinopatické šlachy vykazují zvýšenou hladinu neuropeptidu, substance P (SP), která může kromě své role v nocicepci odrážejí prozánětlivé a trofické účinky. SP reguluje vazodilataci, únik plazmy do okolí a uvolnění cytokininů vazbou na jeho receptor (nerokinin 1), nacházející se šlachách. SP stimuluje proliferaci fibroblastů a endotelových buněk a pravděpodobně také přeměňuje fibroblasty na myofibroblasty zvýšením produkce TGF-b ve fibroblastech. Z toho důvodu může abnormální regulace SP přispět k tendinóze (fibróze), transformaci tenocytů, hypercelularitě a hypervaskularizaci pozorovaných u tendinopatických pacientů. Další neuronální faktory, které jsou při tendinopatii ve velké deregulaci, je neurotransmiter glutamat a jeho receptor (NMDAR1), které pozorovány u různých bolestivých onemocnění.
Jak léčit tendinopatií?
Odpověď na otázku, jak léčit tendinopatii, nám již lehce naznačila předchozí kapitola. Aby docházelo k reparaci šlachy, je nutné, aby byl nastartován proces tvorby kolagenních vláken. A toho docílíme jedině adekvátní dávkovanou zátěží. Nezbývá tedy nic jiného než pravidelně, soustavně cvičit a dostatečně šlachu zatěžovat. Bez progresivního tréninku nedojde k tvorbě kolagenu a šlacha tak nebude dostatečně posílená a odolná vůči námaze, které na ní vyvíjíme, ať už práci nebo sportem. I když časem může dojít k ústupu bolesti, bez dostatečného posílení se šlacha zcela nikdy nevyléčí.
Posílit šlachu můžeme různými způsoby a je jen na nás, jakou cestu si zvolíme. Vždy je však nutné volit cvičení tak, aby bylo šlacha nebyla zatížena ani moc ani málo. Důležité je také upravovat zátěž v návaznosti na to, jaký efekt mělo dřívější cvičení (zda bolest zhoršilo či ne). Pokud začínáme pracovat se šlachou, která je dost bolavá, můžeme v úvodu zvolit izometrické výdrže, které bývají dobře tolerované. Při tomto cvičení držíme pouze aktivitu svalu bez pohybu v kloubu. Postupně můžeme po čase přecházet ke koncentrickém a excentrickému posilování, kde pokračujeme v budování silové kapacity. Po určitém časem přecházíme k plyometrickým a balistickým cviků, tréninku tlumení dopadů, ale i výskoků, odrazů či odhodů.
V terapii tendinopatie je velice důležité, abychom zcela neomezili zátěž na šlachu. Tedy pokud jsme aktivní sportovec, snažíme se zredukovat zátěž tak, abychom nemuseli sport přerušit úplně, ale současně jsme nepodporovali a nezvyšovali bolest šlachy.
Jako podpůrnou léčbu můžeme v terapii tendinopatie využít také například manuální techniky, rázovou vlnu nebo další alternativy, které nám mohou pomoci krátkodobě snížit bolestí, a tím i lépe pracovat se šlachou. Nicméně je stěžejní, abychom měli na paměti, že základ terapii tvoří progresivní cvičení a tyto techniky jsou pouze doplňkové.
Zdroje
- Di Giacomo G, Ellenbecker TS, Kibler WB. Tennis Medicine. 1. vydání. Cham: Springer, 2018. ISBN 978-3-319-71497-4
- Ackermann PW, Hart D. Metabolic influences on risk for tendon disorders. Cham: Springer; 2016. 298 p.
- Pufe T, Petersen WJ, Mentlein R, Tillmann BN. The role of vasculature and angiogenesis for the pathogenesis of degenerative tendons disease. Scand J Med Sci Sports. 2005;15(4):211–22.
- Fong G, Backman LJ, Hart DA, Danielson P,
- McCormack B, Scott A. Substance P enhances collagen remodeling and MMP-3 expression by human tenocytes. J Orthop Res.2013;31(1):91–8.